A definição clássica de zoonoses é a de doenças que são transmitidas de animais para humanos, ou de humanos para os animais. A Organização Mundial da Saúde (OMS) define zoonoses como “Doença infecciosa que passou de um animal não humano para o homem” (OMS, 2020). Exemplo: Raiva, Leptospirose, Toxoplasmose, Leishmaniose, entre outros.
Os patógenos zoonóticos podem ser bacterianos, virais ou parasitários, ou podem envolver agentes não convencionais e podem se espalhar para os humanos por meio do contato direto ou através de alimentos, água ou meio ambiente. Eles representam um grande problema de saúde pública em todo o mundo devido à nossa estreita relação com os animais na agricultura, como companheiros e no ambiente natural. As zoonoses também podem causar interrupções na produção e no comércio de produtos de origem animal para alimentação e outros usos.
As zoonoses constituem uma grande porcentagem de todas as doenças infecciosas recém-identificadas, bem como de muitas doenças existentes. Algumas doenças, como o HIV, começam como zoonoses, mas depois se transformam em cepas exclusivamente humanas. Outras zoonoses podem causar surtos de doenças recorrentes, como o vírus Ebola e a salmonelose. Outros ainda, como o novo coronavírus que causa o COVID-19, têm potencial para causar pandemias globais.
HISTÓRICO
Admite-se que as zoonoses ocorram desde os tempos pré-históricos da humanidade, no entanto é no período neolítico, a partir de oito mil anos antes de Cristo, que as condições favoráveis para transmissão de agentes de doenças transmissíveis entre animais vertebrados e seres humanos se ampliaram, pois foi nesta ocasião que se iniciou estruturação da agricultura, a domesticação dos animais e o há o início da vida urbana organizada em aldeias.
Outro momento na história da humanidade atribuído como importante para a ocorrência e expansão das zoonoses é o período da Idade Média, (800 a 1200 anos depois de Cristo), quando se estruturaram as cidades medievais dentro dos castelos feudais que passaram a reunir condições próprias representadas por: aglomeração de pessoas, alimentos e resíduos que favoreceram o crescimento das populações de animais sinantrópicos, ou seja animais indesejáveis que ocupam o mesmo ambiente utilizado pelos seres humanos. Destes o principal exemplo são os representantes da família Muridae, roedores originários da Ásia que se distribuíram pelo mundo todo através das navegações. Esta condição explica as grandes epidemias de Peste Bubônica, registradas durante a Idade Média.
Após a Segunda Guerra Mundial, com a criação da Organização das Nações Unidas, e a Organização Mundial de Saúde, foi proposta a criação de um setor específico denominado de Saúde Pública Veterinária, que tem por objetivo a coordenação de ações destinadas a: 1) prevenção e controle de zoonoses; 2) higiene alimentar com prevenção das toxinfecções de origem alimentar; 3) prevenção e controle da poluição ambiental de origem animal e 4) medicina comparativa, que objetiva o avanço no conhecimento de doenças humanas com o estudo de condições comparáveis em animais.
CLASSIFICAÇÃO DAS ZOONOSES
Mais de 200 doenças transmissíveis enquadram-se na definição de zoonoses proposta pela Organização Mundial de Saúde. Desta forma, para facilitar o estudo deste grupo de doenças, diversas classificações tem sido propostas:
Classificação das zoonoses segundo o sentido da transmissão:
Antropozoonoses: Agentes de doenças que são perpetuados pela transmissão entre animais porém que podem eventualmente acometer seres humanos. Exemplo: Raiva.
Zooantroponoses: Agentes de doenças que são perpetuados pela transmissão entre seres humanos porém que podem eventualmente acometer animais. Exemplo: Tuberculose em animais pelo Mycobacterium tuberculosis, bacilo do tipo humano.
Anfixenoses: Agentes de doenças que se transmitem com igual intensidade entre animais, entre os seres humanos e também entre animais e seres humanos. Exemplo: COVID-19, Estafilococose.
Classificação das zoonoses segundo os ciclos de manutenção do agente etiológico
Zoonoses diretas: o agente pode persistir com passagens sucessivas por uma única espécie de animal vertebrado . Exemplo, raiva canina.
Ciclozoonoses: o agente necessita obrigatoriamente passar por duas espécies distintas de animais vertebrados para que o seu ciclo se complete. Exemplo, complexo Equinococose-Hidatidose. Dentre as ciclozoonoses são consideradas Euzoonoses as doenças em que o ciclo biológico completo do agente etiológico necessita obrigatoriamente da passagem por seres humanos e animais, exemplo Complexo Teniase-Cisticercose, e Parazoonoses, doenças em que o ciclo biológico pode se completar com dois animais vertebrados, porém, que eventualmente podem atingir seres humanos, exemplo Complexo Equinococose-Hidatidose.
Metazoonoses: o agente necessita passar por hospedeiro invertebrado para que o seu ciclo se complete. Exemplos, Febre Maculosa; Encefalite Eqüina Americana; Doença de Chagas, Leishmanioses.
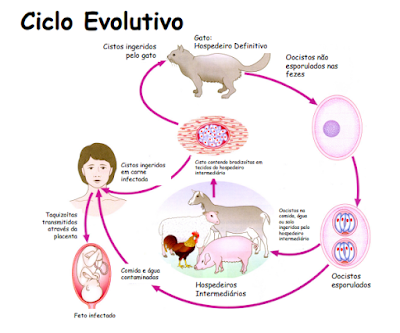
Saprozoonose: o agente necessita passar por transformações que ocorrem no ambiente externo em ausência de parasitismo. Exemplos, Toxoplasmose, Toxocaríase.
***
Fontes:
VASCONCELLOS, Silvio Arruda. ZOONOSES: conceito. Faculdade de Medicina Veterinária e Zootecnia. Universidade de São Paulo [s.d].
http://www.cevisa.ibiuna.sp.gov.br/Arquivos%20para%20baixar/zoonosesconceito.pdf
ZOONOSES. Organização Mundial de Saúde